FDA y plasma convaleciente para tratar COVID-19
La Food and Drugs Administration (FDA) de los Estados Unidos autorizó el uso de emergencia del plasma convaleciente para tratar la COVID-19. Esto se produce un día después de que Trump culpara a la agencia por dificultar el lanzamiento de vacunas contra el coronavirus y de terapias con fines políticos.
El anuncio por parte de la FDA de la llamada «autorización de uso de emergencia» (EUA) para el plasma convaleciente se efectuó este domingo.
Hay que aclarar que, para efectos de la reglamentación de la FDA, no es lo mismo la EUA que una aprobación completa. La agencia emite una EUA cuando «es razonable creer que el producto puede ser eficaz y los beneficios conocidos y potenciales superan los riesgos conocidos y potenciales». Mientras tanto, se llevan a cabo estudios para corroborar la eficacia y seguridad de esta terapia.
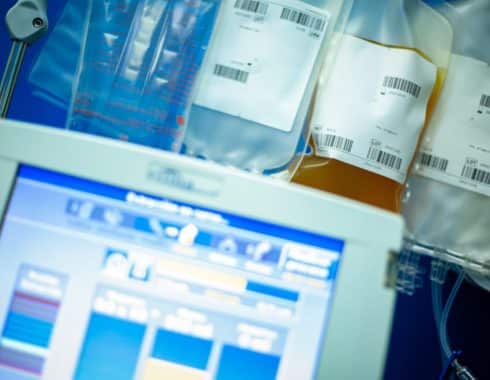
Este plasma sanguíneo de pacientes que se recuperaron del COVID-19, o plasma convaleciente, se puede infundir en otro enfermo. Los anticuerpos que contiene contra el SARS-CoV-2 pueden ayudar a combatir el virus en las primeras etapas de una infección.
El objetivo de esta terapia es brindar protección hasta que el propio sistema inmunológico del paciente genere sus propios anticuerpos en cantidades suficientes para vencer la patología.
¿Plasma convaleciente y estrategia política?
Este anuncio por parte de la FDA se produjo un día después de que el presidente Donald Trump culpara a la agencia por impedir la aplicación de vacunas y terapias contra la COVID-19 por razones políticas.
La FDA aprobó esta EUA en vísperas de la Convención Nacional Republicana, donde Trump será nominado para dirigir su partido durante cuatro años más.
Como respuesta, Trump elogió la medida de la FDA como un «avance» y agradeció al director de la institución, Stephen Hahn, quien participó en la conferencia de prensa, por emitir la EUA y agregó: «La FDA realmente dio un paso al frente para lograr esto».
Por su parte, Hahn aclaró que Trump no había hablado con él ni con la agencia, por lo que no influyó en su decisión del comunicado del domingo.
Este anuncio se produce menos de una semana después de que funcionarios de los National Institutes of Health (NIH) realizaran una inusual intervención para evitar que la FDA emita la autorización de uso de emergencia. Los funcionarios dijeron que se necesitaban datos provenientes de ensayos controlados aleatorios como para autorizar este uso.
El plasma disminuye la mortalidad
La FDA indicó que la evidencia preliminar muestra que el plasma convaleciente puede disminuir la mortalidad y mejorar la condición de los pacientes. Esto se observó cuando se administró el plasma en los primeros tres días de su hospitalización.
Los que más se beneficiaron con este tratamiento fueron los menores de 80 años que no usaban respirador. Estos pacientes tenían una tasa de supervivencia un 35 % mejor un mes después de recibir el tratamiento.
Un estudio de la Mayo Clinic, publicado el 13 de agosto, pero que aún no ha sido revisado por pares, sugirió que el uso de plasma convaleciente para tratar tempranamente a pacientes con COVID-19 grave se asoció con una menor probabilidad de muerte.
Pero este estudio inscribió a más de 35 000 pacientes, no incluyó a un grupo de placebo ni fue aleatorio, lo que dificulta la interpretación de los datos. Además, no ha sido revisado por pares ni publicado en una revista científica.
Hasta ahora, 70 000 pacientes han sido tratados con plasma sanguíneo, según la FDA.
La administración de Trump también anunció el mes pasado el lanzamiento de una campaña publicitaria de US8 millones para alentar a los estadounidenses que se han recuperado de COVID-19 a donar plasma.
Controversia
La EUA obtuvo una rápida reacción de los expertos en salud. Eric Topol, fundador y director del Scripps Research Translational Institute, tuiteó que era «indignante» afirmar que ese estudio había mejorado un 35 % la supervivencia.
Por su parte, Rachel Sachs, profesora asociada de derecho en la Washington University, en St. Louis, escribió que, dada la presión política sobre la FDA, emitir el EUA sin publicar la evidencia y sin un ensayo aleatorizado que lo respalde «corre el riesgo de dañar aún más la confianza pública en la agencia».
Pero el exdirector de la FDA, Scott Gottlieb, tuiteó: «El plasma probablemente sea cada vez más útil para los pacientes con COVID y cumpla con los criterios para una EUA». Y añadió: «Necesitamos mantener las decisiones de la FDA con la FDA. El personal profesional apoyó esto. Es su decisión».
Mientras tanto, la FDA defiende la EUA para el uso del plasma convaleciente. Ellos se apoyan en los estudios con resultados positivos que han logrado en los pacientes tratados. Sin embargo, insisten en continuar con los estudios controlados con placebo a fin de darle mayor solidez a este uso, más aún, en medio de las sospechas de presión política de Trump.