La FDA aprueba la venta del primer dispositivo para reducir los síntomas de la abstinencia de opiáceos
La epidemia de opiáceos en los E.E.U.U. comenzó de manera silenciosa , con la prescripción de recetas para oxicodona, hidrocodona o fentanilo, pensadas como una ayuda en situaciones de hiperalgesia, especialmente crónica. En medio de esta crisis en aumento, muchos estados han cambiado sus leyes para limitar la venta y consumo de estas sustancias, que causan alrededor de 19,000 muertes por sobredosis accidentales al año. El narcotráfico vio esta dependencia como una lucrativa oportunidad de negocio, que se manifestó en un incremento de la venta de heroína, o una mezcla de opiáceos y heroína de prescripción médica.
El problema principal radica en que su uso continuo puede crear dependencia, hecho que se caracteriza por un poderoso e incontrolable deseo de consumir la sustancia, con un evidente deterioro del control de la capacidad para manejar su uso y consumo persistente, aún reconociendo las consecuencias perjudiciales que conlleva.
Esta dependencia a opiáceos es una enfermedad crónica, de difícil manejo, que se relaciona con frecuentes recaídas, asociada con tasas de morbilidad y mortalidad significativamente elevadas.
En general, la descontinuación abrupta de opioides es una medida no recomendada, debido al extremo grado de ansiedad y malestar general que experimentan los usuarios ante una abrupta supresión de su ingesta.
La abstinencia de opiáceos causa síntomas agudos de tipo físico muy intensos que incluyen malestar gastrointestinal, sudoración profusa, agitación, insomnio y dolor articular.
Dentro de las opciones terapéuticas, la metadona es un opiáceo sintético, que se usa como un sustitutivo de la heroína, que puede administrarse por vía oral.
Aún así, estos tratamientos presentan elevadas tasas de fracaso y son necesarios prolongados períodos de desintoxicación, no exentos de recaídas.
El novedoso dispositivo
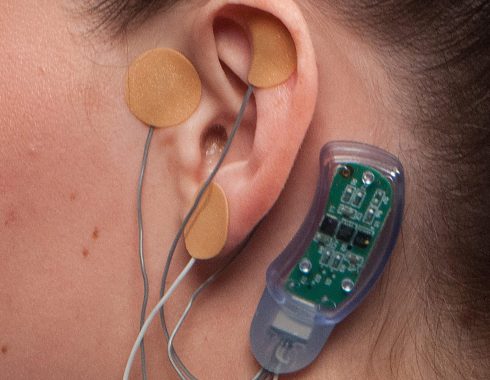
Como una forma de brindar un tratamiento anti recaída más efectivo, la FDA acaba de otorgar la autorización para su comercialización y uso a un dispositivo de estimulación eléctrica diseñado para ayudar a reducir los síntomas de la abstinencia de opiáceos: el Bridge Neurostimulation System ( NSS-2 Bridge). La comercialización del dispositivo estará cargo de la empresa Innovative Health Solutions, Inc.
Este dispositivo es un pequeño estimulador nervioso eléctrico que se coloca detrás de la oreja del paciente. Consta de un chip alimentado por batería que emite pulsos eléctricos para estimular ciertas ramas de nervios craneales. Estos estímulos proporcionan alivio a los síntomas de abstinencia de opiáceos. Los pacientes pueden usar este dispositivo por un período de hasta cinco días, durante la fase aguda que sigue al retiro de la droga.
Metodología de estudio
Para permitir la comercialización de este dispositivo con fines terapéuticos, la FDA revisó los datos de un estudio clínico que incluyó a 73 pacientes sometidos a abstinencia física de opiáceos.
El estudio evaluó la puntuación de la escala clínica CPE de los pacientes , que es una evaluación clínica realizada por un profesional de la salud que mide los síntomas de abstinencia de opiáceos como son: frecuencia de pulso en estado de reposo, sudoración, tamaño de la pupila, problemas gastrointestinales, dolores óseos y articulares, temblores y ansiedad. Las puntuaciones en la Escala Clínica de Abstinencia a Opioides (Clinical Opiate Withdrawal Scale-COWS) oscilan entre 0 y más de 36, cuanto mayor es la cifra, más severos son los síntomas de abstinencia que experimenta un paciente.
Resultados y perspectivas de uso
Antes de usar el dispositivo, el puntaje promedio de la escala COWS para todos los pacientes fue de 20.1. Los resultados del estudio evidenciaron que todos los pacientes mostraron una reducción en las puntuaciones de al menos 31% dentro de los 30 minutos posteriores al uso del dispositivo.
En general, 64 de los 73 pacientes (88%) pudieron hacer el cambio a la terapia medicamentosa posterior a los cinco días de usar el Bridge NSS-2, además de algún fármaco necesario para aquellos síntomas persistentes como son las náuseas y los vómitos.
Este dispositivo está disponible solo por prescripción médica. Su uso está contraindicado en pacientes con hemofilia, con marcapasos o diagnosticados con psoriasis vulgar.
En palabras del comisionado de la FDA Scott Gottlieb, MD: «Dado el alcance de la epidemia de adicción a los opiáceos, debemos encontrar nuevas formas innovadoras de ayudar a aquellos que en la actualidad son adictos a vivir sobrios con la asistencia de un tratamiento médicamente asistido. Hay tres medicamentos aprobados para ayudar a tratar la adicción a los opiáceos. Si bien continuamos buscando mejores medicamentos para el tratamiento del trastorno de uso de opioides, también debemos buscar dispositivos que puedan ayudar en esta terapia «, » La FDA se compromete a apoyar el desarrollo de nuevos tratamientos, tanto las drogas como los dispositivos, que pueden usarse para tratar la dependencia o adicción a los opioides, así como los nuevos tratamientos no adictivos para el dolor que pueden servir como alternativas a los opioides«.