Uso de láser infrarrojo cercano y nanorods de oro para matar células cancerosas

Los usos de la nanotecnología en Medicina están enfocados, dentro de sus múltiples aplicaciones, al campo de la oncología, tratando que el efecto citotóxico sea cada vez más específico, dirigido hacia las células blanco en particular.
Ya que la modificación de la expresión génica varía por completo la expresión proteica y por ende, las respuestas celulares, puede significar un cambio total en la forma de tratar las enfermedades, como es a través de la vehiculización de un gen específico que codifique para una proteína en particular con efecto anti tumoral.
Dentro de las metodologías para conseguir tal control óptico de la expresión génica es el uso del efecto fototérmico como activador sobre los promotores de la proteína de choque térmico (HSP), que se activa, como mecanismo de defensa, frente a situaciones de estrés celular, incluyendo el calor.
Por lo tanto, la activación de HSP por luz láser es una forma eficiente para realizar un seguimiento, tanto espacial como temporal de la expresión de proteínas. La activación HSP por el láser infrarrojo cercano (NIR) en células de mamífero se han realizado previamente en algunos estudios en los que se han usado nanomateriales sensibles a NIR, tales como nanotubos de carbono y nanotubos de sílice-oro , nanopartículas huecas de oro y nanorods de oro (AuNRs).
Los AuNRs también se han desarrollado como vehiculizantes de genes por medio de modificación superficial con polímeros catiónicos.
La novedad japonesa
Los científicos del Instituto para Ciencias Integradas de Materiales Celulares de la Universidad de Kioto Mineko Kengaku, Tatsuya Murakami y sus colegas crearon un nuevo método, publicado en la revista Scientific Reports, que modifica la superficie de los nanorods, incrementando su eficiencia en el transporte de genes dirigidos para la apoptosis de células cancerosas.
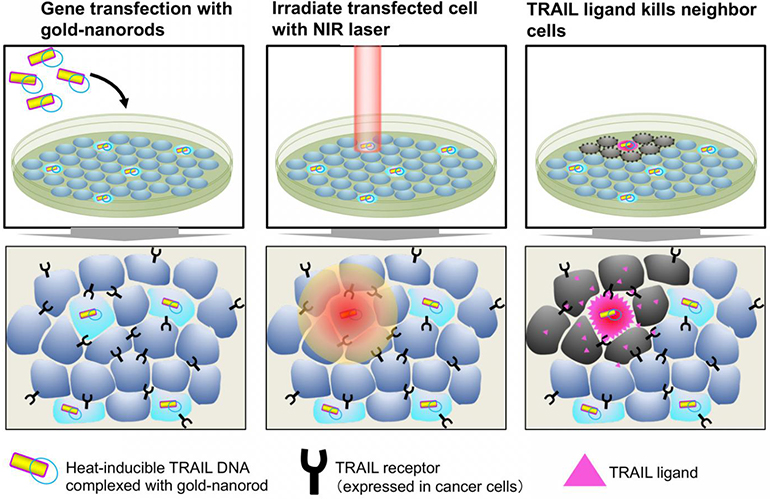
Este sistema transporta genes específicos a las células, vehiculizados a través de nanorods de oro, los cuales son activados en el interior de la célula blanco a través de una señal luminosa. Estos investigadores también desarrollaron un vector de plásmidos, que incorpora en su interior a una «proteína de choque térmico» (HSP) que es activada a través de calor.
Fuente: Medgadget.com
Resumen del procedimiento
En una primera instancia, el equipo científico validó el funcionamiento del sistema, para lo cual unieron el vector al gen que codifica una proteína fluorescente verde (EGFP). Luego se transfirió a las células de mamífero utilizando los nanorods de oro recubiertos con lípidos. Con este sistema, pudieron evidenciar de manera sencilla que el sistema había trabajado, observando las células a través de un microscopio de fluorescencia. En aquellas células en que el gen se había activado había una fluorescencia de color verde brillante.
A continuación, utilizaron el sistema para entregar el gen que codificaba para la proteína TRAIL . Como resultado, la radiación infrarroja de las células transfectadas por nanorods que transportaban TRAIL produjo una elevada tasa de mortalidad en las células cancerosas circundantes, con baja mortalidad de las células no cancerosas.
Complejos Au/ADN plasmídico
Primeramente, se llevó a cabo la preparación de los complejos nanorods de oro (AuNRs)/ADN plasmídico. Estos nanorods a su vez se recubrieron con dos lípidos comunes como son oleato y 1,2-dioleoyl-3-trimetilamonio-propano (DOTAP), para facilitar su penetración a través de la bicapa lipídica de la membrana plasmática, logrando así una efectiva y rápida transfección génica.
Estos nanorods transportaban en su interior un vector génico cuyo contenido es una “proteína de choque térmico”(HSP) que tiene la capacidad de ser activada por calor, que en este caso corresponde a un láser infrarrojo cercano (NIR) con una longitud de onda de 780 mn, que se utilizó para calentar las células transfectadas por 10 segundos.
Esta fotoactivación indujo la expresión génica del promotor HSP, sin fototoxicidad significativa y sin ocasionar efectos nocivos en la población celular circundante.
El gen que contenían los nanorods codificaba para la proteína TRAIL (ligando inducido por apoptosis relacionado con TNF), también conocida como CD 253 o TNF SF 10, corresponde a una citoquina sintetizada por células normales, cuya función es actuar como un ligando que induce la apoptosis, especialmente de las células tumorales, al unirse a determinados receptores de muerte DR 4 y DR 5.
Si bien las proteínas TRAIL y sus receptores han sido utilizados como medios de tratamiento de terapias contra el cáncer desde mediados de los 90, este sistema más sofisticado, podría ser de gran utilidad en las terapias de cáncer molecular, con elevada efectividad, y baja tasa de mortalidad de células no neoplásicas.
Los investigadores concluyen que este nuevo sistema es una gran oportunidad para que se expresen transgenes en células de mamíferos, con una elevada especificidad hacia las células blanco y logrando con este láser NIR, una mínima fototoxicidad sobre las células tratadas. Sin duda, una nueva esperanza para los pacientes enfermos de cáncer.