T-MOC: el dispositivo ‘microfluídico’ que simula el tratamiento oncológico
Los modelos animales se utilizan comúnmente en experimentación para evaluar varios aspectos de la administración de fármacos, como son la eficacia y la citotoxicidad.
Sin embrago, el desarrollo reciente de tecnologías avanzadas de cribado in vitro pueden ayudar en la racionalización y reducción del número de estudios realizados en animales de laboratorio.
A través de la incorporación de técnicas de cultivo de células bidimensionales (2D) o tridimensionales (3D) con métodos microfluídicos, in vitro, se pueden crear plataformas de detección de drogas, tales como células, tejidos y órganos insertos en un chip, para evaluar sus respuestas ante determinados fármacos.
Las plataformas microfluídicas proporcionan varias ventajas únicas para el desarrollo de fármacos, como la determinación de las propiedades físicas relativas al tamaño y la forma, así como la composición del fármaco y los parámetros farmacocinéticos deseados, los cuales se pueden modificar de manera simple y eficaz al ajustar el flujo y las geometrías de las estructuras creadas.
Se ha demostrado que esta nueva tecnología es capaz de simular tejidos tumorales, con una funcionalidad que imita los animales de investigación en las pruebas de fármacos quimioterápicos, lo que representa una herramienta de gran potencial para probar medicamentos antes de tratar a un paciente.
La resistencia a los fármacos oncológicos y la diversidad en cuanto a los subtipos de tumores representan aspectos críticos para lograr la quimioterapia efectiva. Las células cancerosas tienen la capacidad de producir proteínas que le otorgan resistencia a múltiples fármacos, al bombear dichas drogas fuera de las células, ayudándolas a sobrevivir ante la quimioterapia.
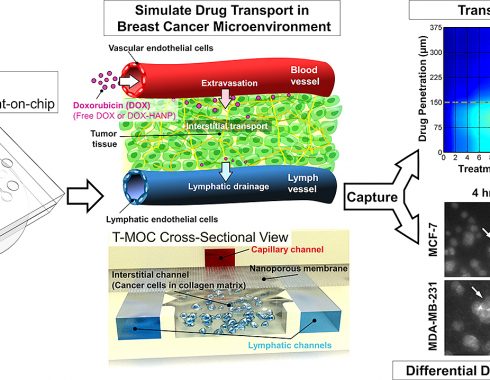
T-MOC: el nuevo dispositivo microfluídico
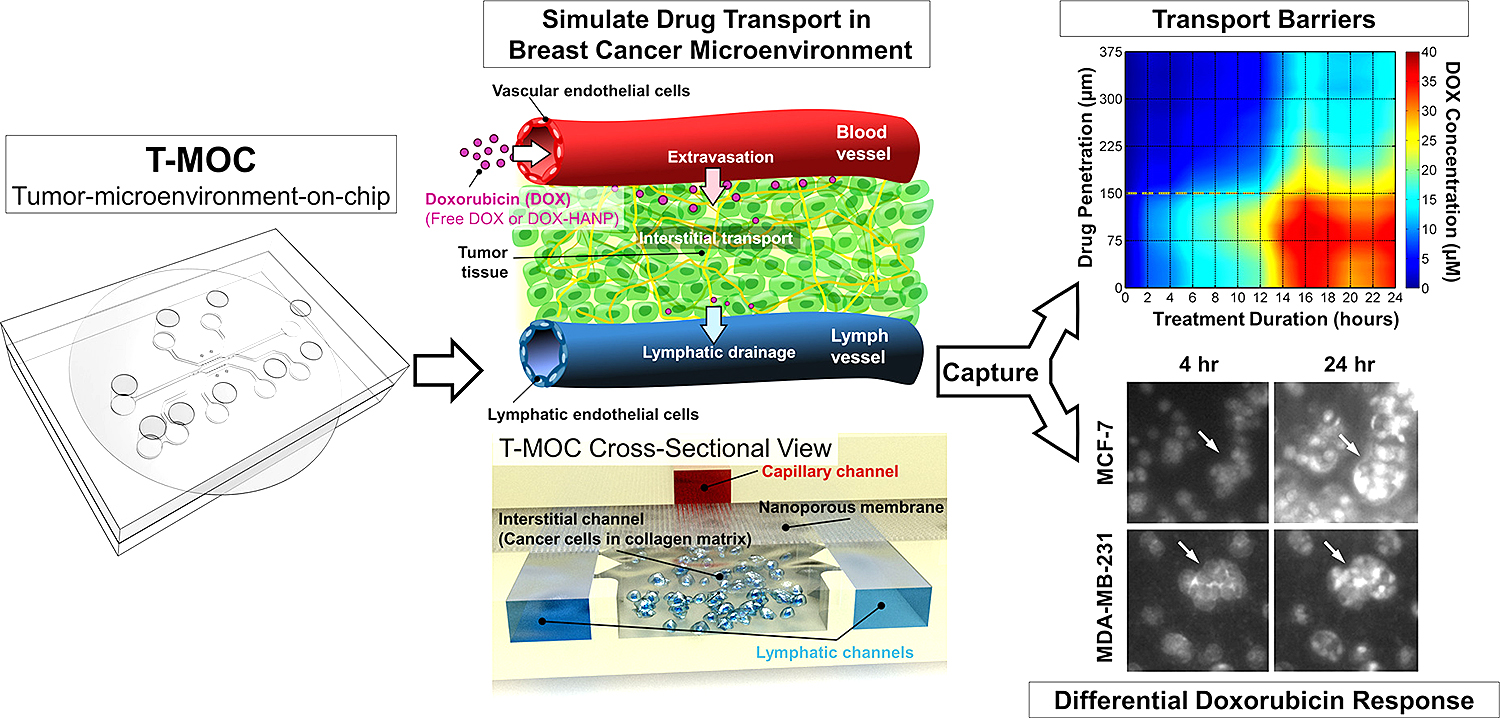
Imagen que muestra el funcionamiento del T-MOC.
Un grupo de investigadores de la Purdue Univesity, liderados por Altug Ozcelikkale, desarrollaron una plataforma de detección de drogas, con el objetivo de imitar estos mecanismos implicados en la multirresistencia a fármacos, así como para validar dichos hallazgos comparlos con el gold standard actualmente utilizado: la investigación con animales pequeños, según explicó Bumsoo Han , profesor de ingeniería mecánica y biomédica de la Purdue University. Los hallazgos de este estudio se publicarán este mes en la Journal of Controlled Release.
El dispositivo T-MOC mide aproximadamente 4,5 centímetros cuadrados y contiene canales «microfluídicos», en los que las células cancerosas se cultivan dentro de una «matriz extracelular» tridimensional, que actúa como un material de andamiaje, simulando al que se encuentra normalmente entre las células del tejido vivo. Para lograr mayor parecido a la realidad del ambiente tisular “in vivo”, los experimentos también incorporan «fluido intersticial», que se encuentra dentro de los tumores y se cree que actúa como una barrera que dificulta la llegada de los fármacos al interior de las células tumorales.
Importancia de este sistema microfluídico “personalizado”
Un objetivo a largo plazo es la incorporación de células cancerosas procedentes de una biopsia del propio paciente para probar la efectividad de diferentes medicamentos, pues como explicó Han: «Hay muchos tipos diferentes de medicamentos para la quimioterapia, por lo que los médicos pueden ser capaces de ver cuáles pueden ser más efectivos que otros». «El suministro exitoso de medicamentos y la superación de la resistencia a los medicamentos son los principales desafíos clínicos para el tratamiento del cáncer. Para abordar este problema, desarrollamos el microambiente tumoral-en-chip (T-MOC)«.
Esto implica que este nuevo sistema podría usarse para «medicina de precisión», altamente personalizada, en la que el tratamiento con medicamentos determinados se adapte a las necesidades y respuestas de los pacientes individuales y a ciertos tipos de cáncer.
Metodología de estudio y resultados
Los científicos utilizaron en el estudio un fármaco quimioterápico común: la doxorrubicina. Este medicamento fue testeado en su forma convencional, comparándolo con una formulación en forma de nanopartículas.
Los investigadores habían demostrado previamente que el dispositivo T-MOC fue capaz de discriminar entre diferentes tipos de células cancerosas.
Los nuevos hallazgos evidenciaron que el T-MOC funcionaba tan bien como para probar la efectividad de los medicamentos, al utilizar las líneas celulares MCF-7 y MDA-MB-231.
Además, el mecanismo molecular implicado en la resistencia a la doxorrubicina en el T-MOC fue consistente con la que se da en la población de roedores, dijo Han.
El estudio también demostró que el T-MOC es capaz de simular la «eliminación plasmática«, una respuesta corporal en la que los medicamentos oncológicos son filtrados a través de los dos órganos detoxificantes por excelencia, el hígado y el riñón, permitiendo que tan solo una pequeña cantidad llegue al tumor.
Ambas líneas celulares que fueron cultivadas en el T-MOC mostraron una mayor resistencia a los fármacos, en comparación con las células procedentes de un cultivo estándar en placa Petri, coincidiendo los resultados con los que se obtienen con ratones, por lo que sugieren un resultado más fidedigno y comparable con modelos animales.
«Esto confirma la capacidad predictiva de T-MOC para la respuesta al fármaco in vivo«, dijo Han. «Esta caracterización inicial de T-MOC indica su potencial transformador para probar la efectividad del fármaco«.
A futuro, el equipo pretende ampliar la investigación sobre diferentes tipos de cáncer, incluidos los de páncreas y próstata.
Con información de Medgadget.






