FDA aprueba primer inhibidor subcutáneo para tratamiento de angioedema hereditario

Esta semana, la Food and Drug Administration, máxima autoridad en la regulación de alimentos y medicamentos en Estados Unidos, aprobó Haegarda, el primer inhibidor de esterasa C1 (humano) por vía subcutánea –bajo la piel- para prevenir ataques del angioedema hereditario (AEH) por sus siglas en inglés, en pacientes adolescentes y adultos.
La vía de administración subcutánea permite una fácil autoinyección en casa por el paciente o cuidador, una vez que se tiene el entrenamiento adecuado.
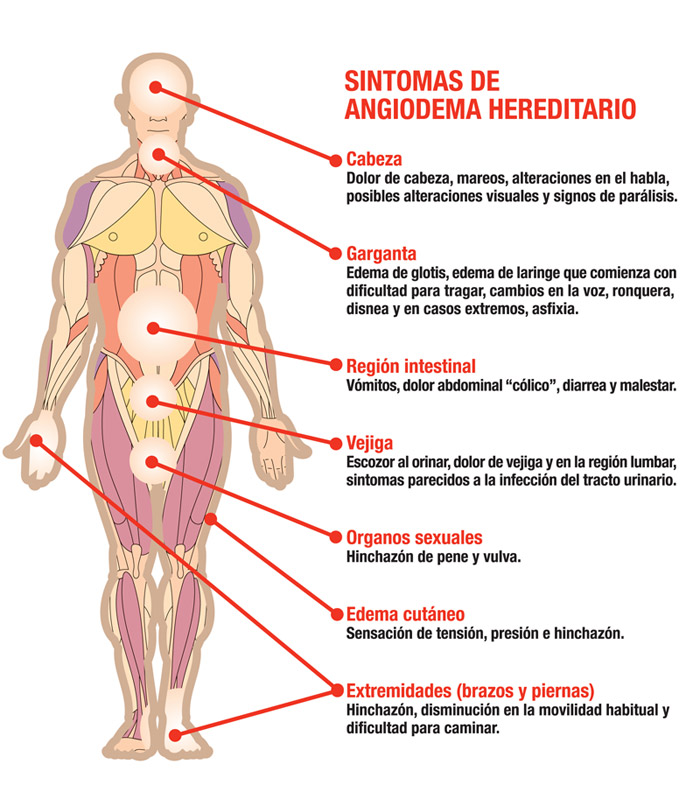
El AEH es causado por tener cantidades insuficientes de una proteína de plasma llamada inhibidor de C1-esterasa (o C1-INH) y afecta aproximadamente de 6.000 a 10.000 personas de la población de Estados Unidos. Además con AEH puede desarrollarse una hinchazón rápida de las manos, pies, extremidades, cara, tracto intestinal o de las vías respiratorias. Estos episodios de inflamación pueden ocurrir espontáneamente o pueden ser desencadenados por el estrés, cirugía o infección.
“La aprobación ofrece una nueva opción de tratamiento para adolescentes y adultos con angioedema hereditario,” comentó Peter Marks, MD, Ph.D., director del Centro de la FDA para la Evaluación e Investigación Biológica. “La formulación subcutánea permite a los pacientes a administrar el producto en casa para ayudar a prevenir los ataques.”
Por su parte, Haegarda es un concentrado liofilizado derivado de plasma humano, purificado, pasteurizado, liofilizado y preparado a partir de grandes concentraciones de plasma humano de donantes estadounidenses. Además está indicado para el tratamiento de la profilaxis de rutina y para prevenir ataques de AEH, aunque no está indicado para el tratamiento de ataques agudos de AEH.
La eficacia de Haegarda fue demostrada en un ensayo clínico controlado y multicéntrico; respecto al estudio, este incluyó 90 sujetos con edades comprendidas entre 12 y 72 años de edad con AE sintomática. Los sujetos fueron asignados al azar a recibir dos veces por semana dosis subcutáneas de 40 UI / kg o 60 UI / kg, y el efecto del tratamiento se comparó con un período de tratamiento con placebo. Durante el período de tratamiento de 16 semanas, los pacientes en ambos grupos de tratamiento experimentaron un número significativamente reducido de ataques de AEH en comparación con su período de tratamiento con placebo.
Entre los efectos secundarios más comunes se incluyeron reacciones en el área de la inyección, de hipersensibilidad (alérgicas), nasofaringitis (hinchazón de los conductos nasales y garganta) y mareos. Además, Haegarda no debe utilizarse en individuos que han experimentado reacciones de hipersensibilidad que ponen en peligro la vida, incluida la anafilaxia, a una preparación de C1-INH o sus ingredientes inactivos.
Haegarda recibió la designación de Medicamento Huérfano, que proporciona incentivos para ayudar y estimular el desarrollo de fármacos destinados a tratar enfermedades raras. El nuevo medicamento está licendiado por la firma CSL Behring LLC.