La FDA prohíbe la Lorcaserina ante riesgo de cáncer

La compañía farmacéutica Eisai retiró del mercado sus medicamentos Belviq y Belviq XR (Lorcaserina HCI), tras un ensayo clínico de seguridad que concluyó que el fármaco utilizado para bajar de peso podría aumentar el riesgo de tres tipos de cáncer: páncreas, colon y pulmón.
A solicitud de la Administración de Alimentos y Medicamentos (FDA) se realizó un análisis en el que participaron 12 000 personas durante 5 años. La agencia estadounidense de control de fármacos concluyó que se diagnosticaron más casos de cáncer en pacientes que tomaban Lorcaserina en comparación con los que lo hicieron con un placebo.
Así que la FDA solicitó que se retirara del mercado y declaró que el «riesgo potencial de cáncer supera los beneficios» que puede traer en cualquier tratamiento de control de peso. La Lorcaserina fue diseñada para reducir la sensación de hambre en las personas con problemas de obesidad y de sobrepeso.
En 2012, la FDA emitió una autorización condicionada para comercializar dicha droga y se pidió al fabricante que realizara un ensayo clínico para evaluar el riesgo de problemas cardiovasculares. Después de esa nueva evaluación, se concluye que el medicamento no es seguro y que posiblemente podría hacer que las personas que lo toman tengan más probabilidades de desarrollar algunas forma de cáncer.
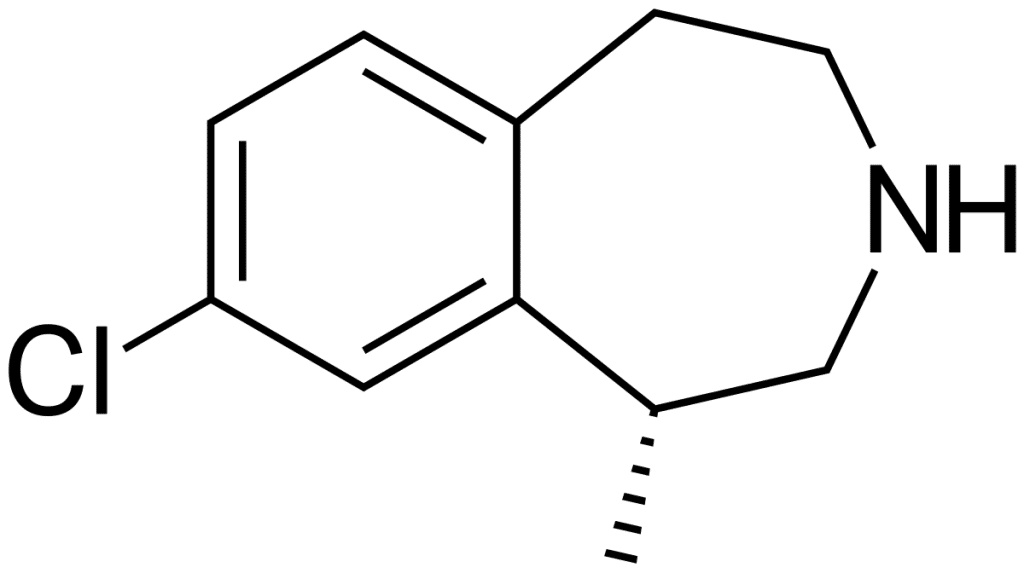
La Lorcaserina, un agonista de los receptores de serotonina 2C, fue aprobado en dosis de 20 mg, una vez al día —con una dieta reducida en calorías y con mayor actividad física—, como auxiliar en la pérdida de peso en adultos obesos o con sobrepeso y con al menos un problema médico relacionado con el peso, como la hipertensión, la diabetes tipo 2 o la dislipidemia. En julio de 2016, la agencia amplió su aprobación a una nueva versión del medicamento con una fórmula de liberación prolongada.
«En este momento, la causa del cáncer es incierta, y no podemos concluir que la Lorcaserina contribuye al riesgo de esta enfermedad. Sin embargo, queríamos concientizar al público sobre este riesgo potencial», informó la FDA en su comunicación oficial.
Es por ello que la agencia estadounidense aconseja a las personas que ya utilizan las tabletas Belviq que las eliminen de manera segura, a través de un establecimiento oficial de devolución de drogas. En caso de no poder hacerlo, entonces deberán depositarlas en la basura, dentro de contenedores cerrados para evitar que contaminen al resto de los desechos.
En cuanto a los profesionales de la salud, la FDA aconseja que dejen de recetar Lorcaserina y que se comuniquen inmediatamente con cualquier persona que ya esté usándola para informarle sobre los riesgos que puede presentar.
«Continuamos evaluando los resultados de los ensayos clínicos y comunicaremos nuestras conclusiones y recomendaciones finales cuando hayamos completado nuestra revisión», señaló la agencia en su declaración.
Previo a esta advertencia de la FDA, los cuestionamientos hacia la Lorcaserina incluían los múltiples efectos secundarios con los que se relacionaba, como el posible daño a las válvulas cardíacas, efectos psiquiátricos, así como problemas de memoria y de atención.
Más de un tercio de los adultos en Estados Unidos son obesos. En México, se calcula que 73 % de los mayores de edad padecen obesidad. Eso equivale a 48.6 millones de personas que enfrentan el principal factor de riesgo para desarrollar enfermedades crónicas, como diabetes mellitus tipo dos, padecimientos cardiovasculares y algunos tipos de cáncer.
Sin embargo, en México, las autoridades sanitarias aún no emiten comunicación oficial respecto al uso de Lorcaserina.
Con información de Medical News Today